بیماری ایدز
ایدز (مخفف عبارت انگلیسی: Acquired Immune Deficiency Syndrome) و معادل «نشانگان نقص ایمنی اکتسابی» است.
در ابتدای ورود ویروس «HIV» به بدن، فرد مبتلا به ایدز نیست و مدت زمان نسبتاً زیادی طول میکشد تا ویروس در سایه بیتوجهی به درمان، فرد را به ایدز مبتلا کند. بنابراین پیگیری مسیر بیماریزایی آن در بدن، گستره دید و نحوه مواجهه صحیح با ایدز را نمایان میکند. تأثیرگذاری مخرب این ویروس با ایجاد عفونت و اختلال در دستگاه ایمنی بدن آغاز میشود. نقص ایمنی حاصل از HIV، به دلایل ژنتیکی، ارثی، جهشهای مادرزادی یا جنینی نیست، بلکه اکتسابی است. اختلال عملکرد ایمنی بعد از عفونت، «نقص ایمنی اکتسابی» خوانده میشود چون بدن قبل از ورود ویروس، از ایمنی برخوردار است ولی با ابتلا به ایدز، دچار نقص خواهد شد.
اولین مورد ابتلا به ایدز
نخستین زمزمهها درباره ایدز در آمریکا شنیده شد. بیماری AIDS را اولین بار، «مرکز کنترل و پیشگیری بیماری آمریکا» (CDC) در سال 1981 تعریف کرد. بنا بر این تعریف علمی، بیماری ایدز به عنوان یک دسته از علائم نقص ایمنی شناخته شد که بیشتر در مردان همجنسگرا بروز کرده بود. یافتههای پژوهشهای، نشان داد ویروس HIV ابتدا در غرب آفریقا و احتمالاً بر اثر جهش، از نوعی ویروسهای حیوانات وحشی ایجاد شده و توانایی بیماریزایی در انسان را پیدا کرده است. با آنکه ایدز اولین بار در افراد همجنسگرا شناسایی شد اما به این معنا نیست که ایدز فقط از طریق ارتباط با همجنس منتقل میشود. هرگونه تماس سطوح مخاطی با ترشحاتِ بدنِ فرد آلوده به ویروس HIV ویروس را منتقل میکند.
راههای انتقال ویروس HIV
راههای انتقال این بیماری عبارتند از:
تماس جنسی محافظتنشده با فرد آلوده
انتقال از طریق برخورد سوزن آلوده با بدن فرد سالم
تزریق با سرنگ آلوده خصوصاً در معتادان به مواد مخدر تزریقی
انتقال عمودی از مادر به جنین در زمان بارداری
انتقال به شیرخوار به علت تغذیه از شیر مادرِ HIV مثبت
راه اصلی انتقال ویروس HIV، تماس جنسی است که در صورت حضورِ توأمان سایر عفونتهای مقاربتی، ریسک انتقال آن بیشتر میشود.
تکثیر ویروس HIV
بین عوامل بیماریزا که عمدتاً شامل قارچها، باکتریها و ویروسها شناخته میشوند، ویروسها بر خلاف دو مورد دیگر، نمیتوانند به تنهایی به زندگی خود ادامه دهند و برای تکثیر، نیاز به استفاده از مواد اولیه و فرآیندهای تکثیری سلول دیگری (موجود زنده) دارند. از نظر بسیاری از میکروبیولوژیستها، ویروسها واحدهای سلولی زنده به حساب نمیآیند به این دلیل که به تنهایی نمیتوانند تولیدمثل کنند.
ژنوم HIV
ویروس HIV یکی از اعضای خانواده «لنتی ویروس» (Lentivirus) از «رتروویروس» (Retrovirus) است که شامل ویروس کمخونیِ عفونی اسبی و ویروسهای نقص ایمنی میمون (SIV) هستند. اطلاعات هسته در سلولهای عادی بدن (Eukaryote)، اغلب به صورت DNA دورشتهای و در هسته سلول قرار دارد. ژنوم ویروس HIV در هسته آن، شامل دو قسمت است:
دو رونوشتِ تک رشتهای از ژنوم «RNA» ویروس HIV
آنزیمهای:
«ترانس کریپتاز معکوس» (Reverse Transcriptase)
«پروتئاز» (Protease)
«اینتگراز» (Intagrase)
در اطراف پروتئینهای هسته این ویروس و «ماتریکس» (Matrix) نیز دولایه چربی مانند وجود دارند که از سلولِ میزبان، مشتق میشوند.
آنزیم ترانسکریپتاز معکوس
کار آنزیم «ترانسکریپتاز معکوس» این است که از RNA ژنوم ویروس DNA ،HIV دورشتهای بسازد بنابراین ژنوم ویروس HIV که به صورت دورشته ای mRNA در هسته ویروس است را نسخه برداری و به cDNA دو رشتهای تبدیل میکند.
آنزیم پروتئاز
انواع و عملکرد آنزیمهای پروتئاز در این ویروس عبارتند از:
پروتئینهای تنظیمی رمزگذاری شده به وسیله ویروس HIV، یعنی پروتئینهای «Rev» و «Tat»، به ترتیب بروز mRNA و انتقال سیتوپلاسمی را تسهیل میکنند.
پروتئینهای هسته ویروس، آنزیمهای ویروسی و پروتئینهای پوششی به ترتیب توسط ژنهای «gag»، «pol» و «env» ویروس HIV رمزگذاری میشوند.
پروتئازهای ویروس، پلیپروتئینهای رمزگذاری شده به وسیله ژنهای «gag» و «pol» را میشکنند و پروتئین پوششی توسط پروتئازها و «گلیکوزیلاز» (Glycosylase) میزبان، شکسته و «گلیکوزیله» (Glycosilation) میشود.
آنزیم اینتگراز
ویروس HIV به کمک آنزیم اینتگراز، DNA ساخته شده از روی RNA خود را به درون DNA میزبان وارد میکند. با این کار عملاً دستوراتی که برای ساخت نسخههای متعدد و جدید ویروس موردنیاز است به اطلاعات مرکزیِ سلولِ میزبان وارد شده و خودِ سلولِ میزبان، کار رونویسی و تکثیر ویروس HIV را انجام میدهد. به این ترتیب ویروس HIV، سلول را وادار به رونویسی و تولید تعداد زیادی از ژنوم ویروس واردشده به سلول میکند تا جایی که تمام منابع سلول، از بین برود و این RNA تولید شده همراه با تکهای از دیواره سلول، از سلول میزبان جدا شود. سلولِ قبلی تخریب میشود اما چرخه تولید ویروس HIV به همین شکل تکرار میشود.
تورم غدد لنفاوی و ایدز
هر موجود زنده برای دفاع از خود در برابر پاتوژنها و مواد خارجی مضر، چند مکانیسم عمل مشخص دارد که در مجموع، سیستم دفاعی بدن آن جاندار را تشکیل میدهد. در داخل بدن، شبکه لنفاوی به عنوان یکی از اجزای سیستم ایمنی بدن وظیفه دفاع را به عهده دارد. شبکه لنفاوی در سراسر بدن گسترده است. این شبکه پس از ورود یک پاتوژن یا میکروب، در مناطق مختلف بدن شروع به دروازهبانی میکند. استفاده از اصطلاح «دروازهبانی» حاوی این معناست که سیستم لنفاوی در نزدیکترین محل ورودِ خطر، دست به کار میشود. به این ترتیب که در مواجهه با عامل بیرونی (میکروب)، کارِ شناسایی و فراخوانی سلولهای ایمنی را آغاز میکند. پس از برخورد پاتوژن، اولین گره لنفاوی انواعی از مواد شیمیایی را آزاد میسازد که «سایتوکاین» (Cytokine) نام دارند و سایر سلولهای ایمنی پراکنده در خون و مغز استخوان را به محل عفونت فرا میخوانند.
نقص سیستم ایمنی اکتسابی
برای آنکه مشخص شود ویروس HIV در بدن انسان چگونه فعالیت میکند، باید به وضعیت بدن در لحظه ورود این عامل بیماریزا نگاهی گذرا کرد. بدن انسان در حالت معمول از حضور دو نوع لنفوسیتِ «T» بهره میبرد که آنها را با نامهای «CD4-کمکی» و «CD8-کُشنده» میشناسند. عملکرد لنفوسیتهای CD4 و CD8 در بزنگاهها آشکار میشود. هنگامی که سلولهای بدن به هر نوع میکروبی آلوده شوند این لنفوسیتهای CD4 هستند که به عنوان مراکز هماهنگ کننده و هادی، شروع به ترشح سایتوکاینها میکنند که فعالیت سایر سلولهای سیستم ایمنی و آمادگی آنها برای مقابله با پاتوژن را افزایش میدهند.
مولکول CD4 گیرنده HIV
مولکولِ CD4 روی سطح لنفوسیتهای «T-کمکی» (T helper)، سلولهای «مونوسیت» (Monocytus) و «ماکروفاژ» (Macrophages) یافت میشود. ویروس HIV روی پوششِ بیرونی خود، دارای نوعی «گلیکوپروتئین» (Glycoprotein) است که تمایل زیادی برای اتصال به مولکول CD4 دارد. روندی که در برخوردِ HIV با CD4 رخ میدهد شامل چند مرحله است:
ویروس HIV به کمک گلیکوپروتئین ِ پوشش خارجیِ خود، به مولکول CD4، ماکروفاژ و مونوسیت وصل میشود.
دیواره ویروس و دیواره سلولی به هم میپیوندند و مجموعه «نوکلئوپروتئینی» (Nucleoprotein) ویروس HIV واردِ سلول میشود. این مجموعه، حاوی ژنوم و آنزیمهایی است که ویروس HIV برای ورود به DNA میزبان، نیاز دارد.
لنفوسیت میزبان، شروع به رونویسی از ژنوم ویروس میکند. سلولهای میزبان، یکی پس از دیگری، تبدیل به مرکز تولید و تکثیر ویروس HIV میشوند. سلولهای ماکروفاژ و مونوسیت هم به عنوان مخزن عمل میکنند.
فرایندِ رونویسی از ژنوم ویروس و تولید و تکثیرِ HIV در سلول تا جایی ادامه مییابد که منابع T helper آلوده به اتمام برسند. بعد از مرگ هر میزبان، ویروس HIV برای ادامه مسیر به سراغ CD4-بعدی میرود.
این چرخه تا جایی ادامه مییابد که شمار سلولهای T-کمکی کاهش یابد تا حدی که لنفوسیتهای باقیمانده، نتوانند این کمبود را جبران کنند. از طرف دیگر فعالیت مغز استخوان برای افزایش تولید CD4 و تعادل لازم در شمارِ T helper-ها بیشتر میشود. وقتی مغز استخوان قدرت جایگزینیِ CD4-ها را از دست میدهد، علائم عفونت ظاهر میشوند. T helper نقش محوری در ایمنی ضدویروسی و عملکرد «B Cell» دارد.
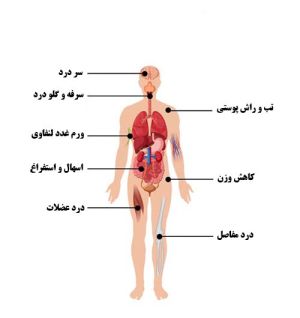
علائم اولیه HIV
از زمان آلودگی بدن با ویروس HIV تا وقتی علائم آلودگی ظاهر شود، مدت زمان کوتاهی طول میکشد که بین دو تا شش هفته متغیر است. اما بعد از عفونت اولیه با ویروس HIV، نیمی از افراد آلوده، دچار سندروم رتروویروسیِ حاد میشوند. علائم حاد در این حالت عبارتند از:
تب
گلودرد
درد مفاصل
بزرگی گرههای لنفاوی
سردرد
راش پوستی (تغییر رنگ تکهتکه پوست) است.
راش پوستی ایجاد شده در «سندروم رتروویرالِ حاد» (Acute Retroviral Syndrome)، به صورت «ماکولوپاپولر» (Maculo Papuler) ظاهر میشود. راش ماکولوپاپولر شایع و کوتاهمدت است و معمولاً تنه یا صورت فرد را گرفتار میکند. تکههایی از پوست مبتلایان با عارضه راش ماکولوپاپولر به قرمز، تغییر رنگ میدهد. این تغییر رنگ در بعضی نواحی همسطح با پوست و در بعضی قسمتها برجستهتر از پوست اطراف است. علائمی که بعد از ورود ویروس HIV به بدن ظهور میکنند از چند روز تا سه هفته به طول میانجامند. بین این نشانهها تب با شیوع 98 درصد، شایعترین علامت است.
علائم ایدز بعد از چند روز مشاهده میشوند؟
روال کلی بعد از ورود ویروس HIV به بدن اینگونه است که سلولهای دستگاه ایمنیِ میزبان به تدریج مبتلا شده و تعداد CD4-ها در بدن کاهش مییابند. اما این روند ظرفِ چندین سال طی میشود. این مدت زمان میتواند در بازه زمانی بین دو تا 10 سال قرار گیرد. هرچند این مدت زمان، مطلق نبوده و زمانهایی کوتاهتر یا بیشتر از زمانِ ذکر شده هم تا کنون ثبت شدهاند. آنچه در این میان قابل استناد است میزان CD4 ها در حجم معینی از خون است. معمولاً تعداد CD4-ها در یک میلیمتر مکعب خون شمارش میشود. این عدد در حالت سلامت بدن بالاتر از 1000 قرار دارد اما از زمانی که میزان CD4 ها بین 200 تا 500 عدد در میلیمتر مکعب قرار گرفت، برخی از علائم در میزبان آغاز میشوند که به این مرحله، مرحله «علامتدار زودهنگام» گفته میشود.
نشانههای مرحله علامتدار زود هنگام
نشانههای ورود به مرحله علامتدار زودهنگام را میتوان بین موارد زیر یافت:
تظاهرات جلدی-مخاطی که راش پوستیِ ماکولوپاپولر نمونهای از آن است.
عفونتهای راجعه تناسلی که با ویروس «هرپس سیمپلکس» (Herpes simplex virus) بروز میکنند. در این مورد، عفونتِ نوع دو ویروس تبخال ایجاد میشود و میتواند در ناحیه تناسلی تکرار شود.
ویروس «واریسلازوستر» (Varicella Zoster Virus) که عامل ایجاد بیماری آبلهمرغان است میتواند عفونتهای چند درماتومی ایجاد کند یعنی علاوه بر قسمت پیشین بدن، دست، پا و صورت را مبتلا کند.
تشکیل ضایعه «لکوپلاکی مویی دهانی» (Oral Hairy Leukoplakia) که در آن دو طرف زبان دچار تغییر رنگ به سفید میشود. کنده شدن این ضایعه موجب خونریزی محل خواهد شد. در صورت مشاهده ضایعه لکوپلاکی مویی دهانی، فرد مشکوک محسوب میشود و لازم است بررسیهای تشخیصی کامل انجام بگیرند.
در مرحله علامتدار زودهنگام، چه اتفاقی در سیستم ایمونولوژیک بدن میافتد؟
پاسخ آنتیبادی به آنتیژنهای پلیساکاریدی مثل آنتیژنهای دیواره باکتریهای «استرپتوکوک پنومونیه» (Streptococcus pneumoniae) و «هموفیلوس آنفلوآنزا» (Haemophilus influenzae) و نیز آنتیژنهای پروتئینی کم میشود. همچنین عملکرد ایمنی سلولی کاهش مییابد. از آنجا که قسمت مرکزی و ستون خیمه عملکرد ایمنی سلولی، لنفوسیتهای CD4 هستند با افت شمار CD4-ها بدن فرد ضعیف میشود؛ اما با کاهش تعداد CD4-ها بسته به شرایط جغرافیایی فرد آلوده، موارد متفاوتی در انتظار اوست. به طور مثال پاسخ آزمون «PPD» در فردِ آلوده به ویروس HIV، وابسته به آنکه بیمار در کدام منطقه سکونت داشته باشد تعاریف مختلفی دارد.
آیا ممکن است بیمار بعد از آلودگی و عفونت با HIV بیعلامت باشد؟
حدود نیمی از افراد آلوده به ویروس HIV دو تا شش هفته بعد از عفونت اولیه، دچار سندروم رتروویروسی حاد میشوند؛ یعنی علائمی مانند تب، گلودرد، بزرگی غدد لنفاوی و راش پوستی، سردرد و درد مفاصل در آنها بروز میکند. این علائم از چند روز تا سه هفته طول میکشد و فرد مبتلا علائم را مانند سرماخوردگی یا یک بیماری «خودمحدود شونده» میپندارد اما 50 درصد دیگر از افرادی که به ویروس HIV آلوده میشوند بیعلامت هستند.
تشخیص زودهنگام HIV
در جریان عفونتِ حاد با ویروس HIV، معمولاً آنتیبادی ضد ویروس HIV در خون قابل کشف نیست اما عفونت HIV را میتوان با بررسیِ RNA ویروس HIV در پلاسما یا آزمون «PCR» تشخیص داد. علاوه بر این، راه دیگری هم وجود دارد. کشف پروتئین «P24» در پلاسما میتواند به تشخیص عفونت با ویروس HIV کمک کند. در مواردی که نیاز به تشخیص زودهنگام عفونت با HIV است معمولاً از یکی از این دو روش خصوصاً آزمون PCR استفاده میشود. تستهای P24 و PCR نسبت به ELISA گرانتر هستند اما میتوانند وجود ویروس HIV در خون را در دوره پنهان ایدز نشان دهند. دوره پنهان ایدز زمانی است که پاسخ آزمون ELISA هنوز مثبت نیست اما فرد به ویروس HIV آلوده شده است.
آزمایش ایدز
سه آزمایش برای تشخیص ایدز به نامهای ELISA ،P24 و PCR وجود دارند که در ادامه توضیح داده شدهاند.
آزمایش ELISA
ELISA عنوان اختصاری عبارت (Enzyme Linked Immunosorbent) به «سنجش سیستم ایمنی مرتبط با ویروس» معنا شده است. در این تست، از بزاق یا خون فرد، نمونه گیری شده و نمونه بر روی کیت تشخیصی ELISA مربوط به HIV قرار میگیرد. آزمون ELISA با این هدف انجام میگیرند که مشخص شود آیا آنتیبادی بر ضد آنتیژنهای ویروس HIV در بدن موجود است یا خیر.
مزایای ELISA
مزیت اول آزمون ELISA آن است که از حساسیت بالایی برخوردار است و افراد مبتلا به ویروس HIV را با تقریب بالای 90 درصد شناسایی میکند. مزیت دوم این آزمون آن است که نسبت به بقیه آزمونها ارزانتر است.
معایب ELISA
مشکل این آزمایش، طولانی بودن زمان تشخیص آن به مدت یک تا سه هفته (از زمان ورود ویروس به بدن) است. به طور مثال اگر امروز از طریق یک سوزن آلوده وارد بدن شده باشد، پاسخ آزمون ELISA در همین زمان مبتواند منفی اما فرد، به ویروس آلوده شده باشد. برای حل این مشکل، دو راه وجود دارد: راه اول این است که از آزمونهای تشخیصی دیگر استفاده شود که به مراتب گرانتر از ELISA هستند اما معمولاً این راه، انتخاب نمیشود. در راه دوم با دو فرد مواجه هستیم:
فرد شماره یک= بیمار مشکوک به آلودگی به HIV حاضر در مرکز درمانی
فرد شماره دو= کادر درمان یا فردی که سوزن آلوده خارج شده از بدن فرد شماره یک، وارد بدن او شده است.
در لحظه ورود سوزنِ آلوده به بدن فرد شماره دو، از شخصِ مشکوک به آلودگی (فرد شماره یک) آزمون ELISA گرفته شود، تا نتیجه آلوده بودن قطعیِ فرد شماره یک نیز مشخص شود. نتیجه دو حالت دارد:
جواب منفی: یک ماه و نیم بعد مجدداً یک آزمون ELISA از فردِ شماره دو گرفته و این کار سه ماه بعد تکرار خواهد شد بنابراین تا انتهای کار، سه آزمون از فرد شماره دو و مشکوک به ابتلا، گرفته شده است. اگر جواب همه این آزمونها (هر سه آزمون) منفی اعلام شود میتوان گفت فرد شماره دو به ویروس HIV آلوده نشده است.
جواب مثبت: اگر در هر یک از این مراحل، آزمون ELISA مثبت اعلام شود به دلیل امکان نتیجه مثبت کاذب در این تست، ابتلای فرد به HIV باید با یک آزمون سرمیِ دیگر نیز تأیید شود که «Western Blot» نام دارد.
منفی کاذب یعنی عفونت در خون فرد وجود دارد اما جواب آزمایش منفی است. مثبت کاذب به این معنا است که عفونت ناشی از ویروس HIV در بدن وجود ندارد اما جواب آزمایش مثبت میشود.
چه کسانی باید آزمون ELISA بدهند؟
افرادی که معتاد تزریقی هستند.
افرادی که فعالیت جنسی پرخطر دارند. کسانی که دارای چندین شریک جنسی هستند به علاوه افرادی که روابط جنسی محافظت نشده دارند یعنی از کاندوم استفاده نمیکنند.
زنان حامله به این دلیل که ممکن است ویروس را به جنین انتقال دهند.
Needle Stick شدن (ورود سوزن آلوده به بدن فرد) حین نمونهگیری و جراحی فردی که HIV مثبت است. این اتفاق باعث میشود انجام آزمون ELISA برای فرد (شماره دو) ضرورت پیدا کند.
تست P24
اگر نتوان برای اعلام جواب آزمون ELISA منتظر ماند، آزمایش P24 جایگزین آن میشود. P24 بخشی از پروتئین ویروس HIV است. این آزمون در حوالی زمانِ ورود احتمالی ویروس به بدن (مثلاً زمانی که سوزن آلوده وارد بدن فرد شده است) از او گرفته خواهد شد. اگر پاسخ آزمون P24 مثبت باشد میتوان گفت فرد به HIV آلوده شده است.
تست PCR
سومین تست برای تشخیص HIV، تست PCR است. در حال حاضر انجام این آزمون نسبت به گذشته ارزانتر شده است و پاسخ آزمون هم ظرف یک تا دو روز آماده میشود. PCR بسیار اختصاصی است به این معنا که اگر پاسخ آن مثبت اعلام شود میتوان گفت فرد با احتمال بسیار زیادی به ویروس آلوده شده است. PCR یا آزمایش زنجیرهای پلیمزار، طی مراحل زیر انجام میشود:
RNA ویروس HIV را از خون استخراج میکنند.
از روی RNA ویروس HIV چندین نسخه میسازد.
تشابه RNA موجود با RNA ویروس HIV بررسی میشود.
تفاوت HIV در نوجوانان و بزرگسالان
نوجوانان آلوده به HIV با سرعتی کمتر از بزرگسالان به سمت ابتلا به بیماری ایدز میروند. کمتر از 30 درصد از این افراد طی 10 سال بعد از عفونت با ویروس HIV، دچار بیماری ایدز میشوند. معنای کلی این است که در افراد بزرگسال سرعت تبدیل شدن ویروس HIV به بیماریِ علامتدار ایدز بیشتر از جوانان به دلیل بیشتر بودن قابلیت جایگزینی CD4 در بدن جوانان است.
مراحل پیشرفت ایدز
پس از ورود HIV به بدن، بلافاصله علائم بیماری مشاهده نمیشوند و در واقع عفونت یک دوره کمون دارد. پس از آن به تدریج فرد وارد فازهای مختلف بیماری میشود که درا دامه به توضیح آنها پرداختهایم.
دوره پنهان ایدز
مرحله بیعلامت است. حدود 50 درصد افراد در عرض 10 سال بعد از عفونت با ویروس HIV دچار بیماری ایدز میشوند. 30 درصد افراد آلوده، علائم خفیف پیدا میکنند و زیر 20 درصد از آلوده شدهها به ویروس HIV تا 10 سال بعد از عفونت هم دچار بیماری ایدز نمیشوند. نوجوانان آلوده به ویروس HIV با سرعت کمتری به سمت بیماری ایدز میروند. جنسیت و نوع ابتلا ارتباطی با سرعت پیشرفت ایدز ندارد. اغلب تا زمانی که CD4-ها به زیر 200 عدد در cc افت نکند بیمار بیعلامت میماند. تب، شایعترین علامت در سندروم رتروویرال حاد است و شیوع آن به 95 درصد میرسد. سردرد با 35 درصد، کمترین میزان شیوع را در سندروم رتروویرال حاد دارد.
کاهش CD4 و پاسخ ایمنی
زمانی است که میزان لنفوسیتهای CD4 کاهش یافته و به 200 تا 500 عدد در هر میلیمتر مکعب خون میرسد:
پاسخ آنتیبادی به آنتیژن پروتئینی باکتریها کاهش مییابد.
پاسخ آنتیبادی به آنتیژن پلیساکاریدی باکتریها کاهش مییابد.
این دو رخداد باعث افزایش چهار برابریِ عفونت ریه در فرد آلوده به ویروس به خصوص هموفیلوس آنفلوآنزا و استرپتوکوک پنومونیه دیده میشوند. عملکرد ایمنی سلولی کاهش مییابد و این به معنای شعلهور شدن «سل ریوی» (Tuberculosis) در نواحیِ آندمیک است.
مرحله علامت دار زودهنگام
به تدریج که تعداد لنفوسیتهای CD4-ها از 500 عدد در cc پایینتر میآید به ترتیب زیر، این بیماریها به صورت غیرمعمول و شدید در بدن فرد ایجاد میشوند:
تبخال نوع یک (HSV-1) و تبخال دو (HSV-2) در چندین قسمت بدن به صورت همزمان و تشدید سل ریوی در نواحی آندمیک
برفک حلقی
سفید شدن دور زبان به علت عفونت قارچی
ایجاد تومور عروقی به صورت جلدی-مخاطی «سارکوم کاپوزی» (Kaposi s Sarcoma)
تغییر شکل بدخیم در سلولهای گردن رحم
عفونتهای باکتریایی راجعه در ریه
مرحله علامتدار پیشرفته
CD4-ها به زیر 200 کاهش مییابند و نقص ایمنی شدید رخ میدهد. افراد در این مرحله، در معرض ابتلا به عفونتهای فرصت طلب متعدد و همزمان قرار میگیرند که در حالت عادی، افراد سالم را مبتلا نمیکنند. با توجه به نقش محوری لنفوسیتهای CD4 در دفاع از بدن در مقابل عوامل بیماریزا طبیعی است که با کاهش CD4-ها عواملی باعث بیماری در مبتلایان به ایدز میشود که در افراد سالم بیماریزایی نمیکنند.
CD4 میان 100 تا 200
عفونت ریه با قارچ «پنوموسیستیس جیرووسی/ کارینئی» (Pneumocystis jirovecii)
تومور عروقی در داخل شکم یا سارکوم کاپوزی
درگیری پیشرونده چندکانونی در مغز
لنفوم غیرهوچکینی (NHL)
CD4 زیر 100
عفونت قارچ «کاندیدا» (Candida) داخل مری گسترش مییابد.
عفونت شبکیه با ویروس (CMV)؛ این عفونت به خصوص با رسیدن تعداد CD4-ها به زیر عدد 50 رخ میدهد.
عفونت مغز با تک سلولی «توکسوپلاسما گوندئی» (Toxoplasma gondii)
مایکوباکتریوم آویوم (Mycobacterium avium)
CD4 زیر 50
در نهایت وقتی تعداد لنفوسیتهای CD4 به زیر 50 عدد در cc رسید وضعیت سرکوب شدید ایمنی رخ میدهد. در صورتی که درمان ضد رتروویروسی مؤثر انجام نشود، بیمار به احتمال زیاد طی یک یا دو سال فوت خواهد کرد.
تشخیص اولیه HIV
فرد آلوده به ویروس اچ آی وی حتی اگر درمانی انجام ندهد بین 10 تا 12 سال زنده میماند. با پیشرفت داروهای تولید شده، مدیریت، درمان و شناسایی زودهنگام، طول عمر افراد مبتلا به بیماری ایدز افزایش پیدا کرده است. هرچند نمیتوان گفت طول عمر آنها به اندازه افراد نرمال رسیده است. اقدامات اولیه برای فردی که به تازگی به ویروس اچ آی وی آلوده شده شامل موارد زیر هستند:
تأیید آزمون مثبت HIV
دریافت شرح حال
معاینه فیزیکی کامل در فواصل سه تا چهار ماهه
ارزیابی میزان HIV-RNA پلاسما و سلولهای CD4 و تکرار با فواصل سه تا چهارماهه
انجام آزمون سنجش بار ویروس (PVL)
شمارش تعداد لنفوسیتهای CD4
آزمون پوستی سل (PPD)
سنجش آنتیبادی توکسوپلاسما پایه
سرولوژی سیفیلیس
اندازهگیری آنتیبادیهای هپاتیت A، B و C
آزمون عملکرد کبد
رادیوگرافی قفسه سینه
تست پوستی سل (PPD)
عفونت با اچ آی وی میتواند مقاومت بدن در برابر باکتری سل را کاهش دهد. آزمون پوستی سل با دو هدف از فرد آلوده به ویروس HIV گرفته میشود:
آیا فرد آلوده به ویروس HIV به سل مبتلا شده و نیازمند درمان است؟
آیا ایمنی بدن فرد آلوده به HIV چقدر کاهش پیدا کرده است؟
آزمون پوستی سل در افراد معمولاً داخل جلد قدامی ساعد انجام میشود، به نحوی که مقداری مایکوباکتریوم، زیر پوست فرد سالم تزریق میشود. بعد از 2-3 روز از تزریق این باکتری، دورِ محل تزریق را خط میکشند. واکنش بدن به صورت تورم، خارش، قرمزی در محل تزریق مشخص میشود. تنها وجود یا عدم وجود سفتی و قطر سفتی محل تزریق است که معیار تشخیص قرار میگیرد. این معیار در مناطق مختلف، اعداد مختلفی دارد. در آمریکا و اروپا اگر قطر سفتی محل تزریق یکونیم سانتیمتر باشد، پاسخ آزمون مثبت در نظر گرفته میشود اما در برخی از نقاط ایران این محدوده یک سانتیمتر در نظر گرفته شده است. در فرد HIV مثبت، اگر قطر سفتی محل تزریق، پنج میلیمتر یا بیشتر باشد آزمون پوستی سل یا PPD او مثبت محسوب میشود اما این به این معنا نیست که فرد، بیماری سلِ فعال دارد.
دو شاخص تشخیصی HIV
برای ارزیابی شدت نقص ایمنی در بدن فرد آلوده به HIV و همچنین ضرورت آغاز درمان از دو شاخص آزمایشگاهی بهره میگیرند:
شمارش تعداد CD4 در خون: بر اساس تعداد CD4-ها است که الگوریتم مواجهه با عفونت ناشی از HIV چیده میشود.
اندازهگیری «PVL»: این آزمون، بار ویروسی پلاسما را میسنجد. اندازهگیری PVL راهنمای بسیار مهمی برای شروع درمان است و اثربخشی درمان را نشان میدهد.
درمان ایدز
برای درمان عفونت با ویروس HIV از یک دارو یا از یک دسته از داروها استفاده نمیشود بلکه ترکیبی از داروها مورد استفاده قرار میگیرند که هریک عملکرد خاصی دارند. تاکنون چهار دسته دارویی توسط سازمان غذا و داروی آمریکا (FDA) برای درمان عفونت HIV تأیید شدهاند. اولین روش درمانی عفونت HIV، درمان ضد رتروویروسی است:
هفت نوع آنالوگ نوکلئوزیدی مهارکننده آنزیم ترانس کریپتاز معکوس HIV
دو نوع مهارکننده غیرنوکلئوزیدی آنزیم ترانس کریپتاز معکوس HIV
9 نوع داروی مهارگر پروتئاز HIV
یک عدد داروی مهارگر ورود ویروس HIV
هدف درمان ضد رتروویروسی رساندن PVL به مقداری است که توسط حساسترین آزمونها قابل شناسایی نباشد.
درمان ضد رتروویروسی
نکته مهم در مورد بیماران آلوده به HIV این است که چه زمانی درمان ضدرتروویروسی یا سایر درمانهای مکمل برای آنها آغاز شود. برای گروههای زیر باید درمانهای ضد رتروویروسی آغاز شود:
با هر تعداد سلول CD4
بیمارانی که علامتدار هستند مثلاً درگیر عفونت فرصتطلب شدهاند بدون توجه به تعداد سلولهای CD4 درمان دریافت میکنند.
بیمارانی که دچار برفک دهانی شدهاند بدون توجه به تعداد سلولهای CD4 درمان دریافت میکنند.
بیماران بدون علامتی که تعداد لنفوسیتهای CD4 آنها کمتر از 200 عدد در cc باشد.
بیماران بدون علامتی که تعداد CD4 آنها بین 200 تا 350 باشد و بیشتر از 100 عدد در سال افت کند.
بیماران بدون علامت که CD4 آنها بین 200 تا 350 و PVL آنها بالاتر از 50 تا 100 هزار باشد.
بهتر است درمان ضدرتروویروسی قبل از علامتدار شدن فرد آلوده به ویروس HIV شروع شود. هدف از درمان این است که میزانِ PVL به زیر مقادیری برسد که با دقیقترین آزمون تشخیصیِ قابل اندازه گیری ویروس در خون (PCR) نتوان ویروسی در خون یافت. معمولاً اگر میزان ویروس در هر میلیمتر مکعب از خون، کمتر از 50 تا 75 نسخه باشد آزمون PCR آن را پیدا نمیکند. پس با درمانهای ضد رتروویروسی کاری انجام میشود که PVL یا بار ویروسی پلاسما قابل اندازهگیری نباشد. آزمون VL در فواصل یکسان (هر سه تا چهار ماه) تکرار میشود. بسیاری از بیمارانی که تحت درمان ضدرتروویروسی قرار دارند حتی بعد از افزایش شدید PVL هنوز وضعیت بالینی مناسبی دارند و تعداد لنفوسیتهای آنان هم افت نمیکند. این افراد در صورت توقف درمان ضدرتروویروسی اغلب علامتدار میشوند.
مسیر درمان ایدز
در مواردی ممکن است پزشک معالج، ناگزیر مسیر درمان ضدرتروویروسی را تعویض کند. در این مواقع، در نوبت اولِ تغییر حداقل باید دو داروی ضدرتروویروسی تغییر کند. به طور معمول درمانها در افرادی با نشانههای زیر تغییر میکنند:
اگر PVL افراد بدون علامتی که برای بار اول، درمان میگیرند طی دو هفته اولِ شروع درمان، 10 برابر کاهش نیابد درمان باید تغییر کند.
اگر PVL افراد بدون علامتی که برای بار اول درمان میگیرند طی 12 تا 24 هفته بعد از شروع درمان، هنوز قابل کشف در آزمایش باشد.
در صورتی که پس از ماهها یا سالها درمان و سرکوب کافی ویروس، PVL در دو نوبت متوالی در نمونه خون قابل کشف باشد.
درمان علائم سندرم نقص ایمنی
روش درمان سندرم نقص ایمنی اکتسابی، به سطح CD4 بیمار بستگی دارد:
CD4 بالاتر از 200: عفونتهای فرصت طلب خطرناک رخ نمیدهند. در نتیجه عفونتهای فرصت طلب به درمانهای معمول و اختصاصی پاسخ میدهند و نیازی به درمان پیشگیرانه نیست.
CD4 کمتر از 200: پس از درمان عفونت حاد، داروی ضد پاتوژن با دوز کمتر، جهت پیشگیری از عود عفونت ادامه مییابد.
فقط وقتی که درمان ضدرتروویروسی پاسخ داد یعنی میزان CD4 به بالای 200 عدد در هر میلیمتر مکعب خون رسید و عملکرد ایمونولوژیک بدن به صورت نسبی احیا شد، قطع دارو منطقی است. بنابراین اگر در پی درمان ضدرتروویروسی مؤثر، تعداد لنفوسیتهای CD4 در فواصل پایش سه ماهه و در دو نوبت، به بالای 200 رسید، میتوان این داروهای پیشگیرانه را قطع کرد:
ضد پنوموسیستیس جیرووسی-کارینی (PCP)
ضد مایکوباکتریوم آویوم داخل سلولی (MAI)
ضد توکسوپلاسما گوندئی (TOXO)
ضد سایتومگالوویروس (CMV)
برای بیمارانی که درمان ضدرتروویروسی دریافت میکنند اگر اندازهگیری CD4 در دو نوبت پیاپی در فواصل زمانی سه ماهه، بالای 200 باشد، میتوان پیشگیری دارویی علیه PCP، مایکریوم آویوم داخل سلولی، CMV و توکسوپلاسما گوندئی را قطع کرد.
بیماریهای جلدی مخاطی
این بیماریها در زمینه نقص ایمنی ناشی از بیماری ایدز ایجاد میشوند:
«برفک دهانی» (Stomatitis candida) اغلب اولین عفونت فرصت طلب شناخته شده است.
لکوپلاکی مویی دهانی (OHL) یک ضایعه لیکنیفیه (ضخیم شدن پوست) سفید و پلک مانند بوده که بیشتر از همه در سطوح جانبی زبان دیده میشود. این ضایعه دردناک نیست و ممکن است به طور خودبهخود عود کرده و بهبود پیدا کند. برخلاف برفک، ضایعات OHL را نمیتوان با آبسلانگ تراشید.
زخمهای دردناک دهان که ممکن است به وسیله عفونت با هرپس سیمپلکس به وجود آیند اما غالباً بر اثر ضایعات آفتی با علت نامعلوم ایجاد میشوند.
سارکوم کاپوزی یک نوع ضایعه بدون درد است که در اثر بزرگ شدن، خونریزی یا زخمی شدن باعث ایجاد علامت میشود. سارکوم کاپوزی یکی از سرطانهای جلدی عروقی درجه پایین در زمینه ایدز است که هم میتواند در سطوح جلدی و هم در احشا ایجاد شود.
بیماریهای مری
کاهش تعداد CD4 به زیر ۱۰۰ در هر میلیمتر مکعب از خون احتمال عفونت قارچی یا ویروسی ازوفاژیت را افزایش میدهد. علائم ازوفاژیت شامل درد هنگام بلع و سوزش پشت جناغ هستند. درمان ضد قارچ را به صورت تجربی آغاز میکنند و به مدت سه تا پنج روز ادامه میدهند. در صورت عدم بهبود با داروی ضد قارچ، نیاز به انجام آندوسکوپی و کشت وجود دارد. این درمان ضد رتروویروسی بر اساس ویروس عامل ازوفاژیت به صورت تخصصی انجام میشود.
بیماریهای دستگاه تناسلی
سیستم تناسلی در مبتلایان به ایدز دچار مشکلات متعددی خواهد شد از جمله:
زخمهای راجعه تناسلی (اغلب ناشی از هرپس سیمپلکس)
«سیفیلیس اولیه» (Primary Syphilis)
«ولوواژینیت» (Irratative Vulvovaginosis) تحریک کننده بر اثر کاندیدا
«تریکومونیاز» (Trichomoniasis)
«واژینوز باکتریایی» (Bacterial Vaginosis)
تکثیر سریع زگیلهای تناسلی
افزایش خطر «دیسپلازی گردن رحم» (Cervical Dysplasia)
افزایش خطر ایجاد کارسینوم مقعد در مردان مبتلا به پاپیلوماویروس
بیماریهای سیستم عصبی
فعالیت ویروس اچ آی وی منجر به اختلالات عصبی زیر میشود:
اختلال عملکرد شناختی: کمپلکس دمانسی ایدز (ADC) شروع میشود و ماهها تا سالها پیشرفت میکند. مراحل اولیه ADC با افسردگی بالینی همپوشانی دارد که در تشخیص و درمان به آن توجه میشود.
در ADC تنها شواهدی از قبیل آتروفی (Atrophy) توأم با بزرگ شدن شیارها و بطنها در CT scan مشاهده میشود. با این حال آزمایش، مایع مغزی نخاعی غالباً طبیعی است.
ضایعات کانونی سیستم اعصاب مرکزی «CNS»
بیماران مبتلا به ایدز در صورت وجود یکی از سه نشانه زیر باید CT scan یا MRI انجام بدهند:
نشانههای عصبی کانونی
تشنجهایی که جدیداً شروع شده
شروع اختلال شناختی پیشرونده
شایعترین علل ضایعات کانونی سیستم عصبی مرکزی
در مبتلایان به HIV، شایعترین علت ایجاد ضایعات کانونی سیستم عصبی مرکزی عبارتند از:
توکسوپلاسموز با علامت تب، سردرد پیشرونده و اختلالات فوکال عصبی است. پس از تأیید تشخیص توکسوپلاسموز مغزی درمان با «پیریمتامین» + «سولفادیازین» + «فولینیک اسید» آغاز میشود. بین ضایعات ناشی از توکسوپلاسما و موارد دیگر تفاوتهایی وجود دارد:
ضایعات TOXO با MRI بهتر دیده میشود.
CT scan و MRI، ضایعات متعدد RING ENHANCED دیده میشود.
لنفوم CNS که درمان آن عبارت است از رادیوتراپی
«لکوآنسفالوپاتی چندکانونی پیشرونده» (Progressive Multifocal Leucoencephalopathey) یا (PML): در MRI بیماران PML ضایعات متعددی در ماده سفید مغز دیده میشود اما CT scan مغز آنها نرمال است.
بیوپسی مغز
در موارد شک به «آنسفالیت» (Encephalitis) توکسوپلاسمایی در سه مورد باید بیوپسی مغز انجام شود:
تظاهرات آتیپیک
فقدان آنتیبادی سرمی علیه توکسوپلاسما
در بیمارانی که ضایعات آنها پس از 10-14 روز درمانِ ضد تکیاختهای پاسخ نداده است.
علائم PML
این علائم عبارتند از:
دمانس پیشرونده
اختلال بینایی
حملات تشنجی یا فلج نیمی از بدن
بیماریهای CNS بدون نشانه کانونی برجسته
مننژیت آسپتیک (Aceptic Meningitis) که علائم آن عبارتاند از سردرد بدون اختلال حسی یا اختلال حرکتی
مننژیت مزمن که پاتوژن اصلی ایجاد آن کریپتوکوک (Cryptococcus) و همراه با علائم زیر است:
سردرد
تب
تغییر قوای حسی
مایکوباکتریوم توبرکولوزیس (Mycobacterim tuberculosis)
کوکسیدیوئیدومایکوز (Coccidioidomycosis)
هسیتوپلاسموز (Histoplasmosis)
مننگوآنسفالیت (Meningoencephalitis) که با تب، اختلال معاینه عصبی به صورت منتشر و اختلال (Electro Encephalo Geraphy) خود را نشان میدهد.
در آنسفالیت CMV، بیماران با تابلوی گیجی، اختلالات اعصاب جمجمهای مراجعه میکنند.
بیماریهای ریوی
با توجه به کاهش کارایی سیستم ایمنی، پنومونی باکتریایی در بیماران HIV مثبت، سه تا چهار برابر میشود که کاهش قدرت پاسخگویی در برابر آنتیژنهای پلیساکاریدی (کاهش ایمنی وابسته به آنتیبادی) را در پی دارد. در نتیجه شانس عفونت با باکتریهای کپسولدار همچون استرپتوکوک پنومونیه و هموفیلوس آنفلوآنزا افزایش مییابد. از دیگر علل ایجاد پنومونی در افراد آلوده به HIV، پنوموسیستیس جیرووسی-کارینئی با علائم زیر است:
سرفه بدون خلط
عدم تجمع مایع دور ریوی (Pleural Effusion)
عدم تطابق حال عمومی بیمار با عکس ریه: نشانهای از درگیری ریه در عکس دیده نمیشود اما حال عمومی بیمار وخیم است.
درمان مؤثر علیه پنومونی پنوموسیستیز جیرویسی-کارینئی، دوز بالای کوتریموکسازول به مدت سه هفته است.
عوارض جانبی کوتریموکسازول
تب
راش پوستی
گرانولوسیتوپنی (Granulocytopenia)
سل ریوی فعال
سل ریوی فعال، ممکن است در شرایطی که تعداد CD4 بالای 200 عدد در میلیمتر مکعب است هم رخ دهد. علائم سل ریوی که در رادیوگرافی قفسه سینه دیده میشود، شامل موارد زیر هستند:
آدنوپاتی ناف ریه (Hilar Lymphadenopathy)
درگیری لوب تحتانی میانی ریه
سل ارزنی (Miliary TB)
Pleural Effusion
طرحهای کلاسیک فعال شدن مجدد عفونت
سل ریوی و سل غیر ریوی اغلب به سرعت به درمان ضد سلی استاندارد چهار دارویی پاسخ میدهند.
درمان پیشگیرانه سل برای افراد HIV مثبت
تا اینجا مشخص شد که عملکرد سیستم ایمنی فرد آلوده به ویروس HIV به مرور دچار نقصان میشود. درمانهای پیشگیرانه در مورد برخی بیماریها قدرت مواجهه فرد با آن بیماری را افزایش میدهد به شرط آنکه در زمان مناسب و قبل از کاهش توانایی بدن در ساخت آنتیبادیهای مربوطه برای درمان پیشگیرانه اقدام شود. به طور مثال، یک فردِ HIV مثبت که PPD او پنج میلیمتر یا بزرگتر است به مدت یک سال تحت درمان پیشگیرانه با «ایزونیازید» قرار میگیرد.
راهکار دیگر آن است که واکسن پنوموکوک در ویزیت اولیه برای فرد تزریق شود. این کار از آن جهت انجام میشود که با پیشرفت عفونت HIV قدرت پاسخگویی بدن به باکتری و سایر ویروسها کمتر میشود. به همین دلیل این واکسن در اولین فرصت به فرد تزریق میشود تا آنتیبادی کافی در بدن فرد ایجاد شود.
بیماریهای گوارشی
اسهال متناوب در تعداد زیادی از مبتلایان به ایدز رخ میدهد و ممکن است ناشی از انواع میکروارگانیسمها یا داروهای ضدویروسی باشد. در در صورت عدم شناسایی عامل، اسهال به آنتروپاتیِ (Enthropathy) منتسب میشود که مشخصه آن آتروفی ویلوس (Villus Atrophy) است. در اسهال مداوم، نمونه تازه مدفوع باید از نظر وجود انگلها بررسی شود. شایعترین عفونت تک یاختهای روده در مبتلایان به ایدز، «کریپتوسپوریدیوم پارووم» (Cryptosporidium parvum) و «ایزوسپورابلی» (Isospora belli) است. در ابتلا به کریپتوسپوریدیوم پارووم، داروهای ضدرتروویروسی و در ایزسپورابلی با «کوتریموکسازول» درمان آغاز میشود.
تب غیرقابل توجیه
تب به همراه آنمی و CD4 زیر 50، عفونت مایکوباکتریوم آویوم داخل سلولی و تب همراه با کاهش وزن لنفومهای غیرهوچکینی مهاجم را نشان میدهد. تشخیص دقیق علت با بیوپسی گرههای لنفاوی شکمی و از طریق CT scan انجام میشود.
کاهش وزن و بی اشتهایی
اگر همراه با افزایش تریگلیسیرید خون باشد و افت فشار خون و افزایش پتاسیم خون را همراه داشته باشد باید احتمال نارسایی غده فوق کلیوی به علت عفونت با «سایتومگالوویروس» (Cyto Megalo Virus) را در نظر داشت.
بدخیمی مرتبط با ایدز
سارکوم کاپوزی اغلب در مردان همجنسگرا دیده میشود و آلودگی با ویروس (HHP-8) علت آن است. گاهی ضایعات پس از آغاز درمان ضدویروسی مؤثر برطرف میشوند. در سارکوم کاپوزی منتشر یا احشاییِ علامتدار، درمان مؤثر شیمیدرمانی سیستمیک است. لنفوم غیرهوچکینی سلول B در مبتلایان به HIV حدوداً 200 برابر بیشتر از افراد دیگر روی میدهد. این نوع لنفوم هرگز در گرههای لنفاوی ایجاد نمیشود و تظاهرات گوارشی و داخل جمجمهای در آنها شایعتر است.
درمان بدخیمی مرتبط با ایدز
شیمی درمانی سیستمیک و در صورت درگیری داخل جمجمهای، اضافه کردن پرتودرمانی عموماً پاسخ بالینی کوتاهمدتی دارند.
عوارض کلیوی در ایدز
مبتلایان به ایدز به چندین دلیل دچار نارسایی کلیوی میشوند:
عوارض تجویز داروهای نفروتوکسیک (Nephrotoxic)
تزریق هروئین
نفروپاتی مرتبط با ایدز (HIVAN)
پیشگیری علیه عفونت ناشی از ایدز
از آنجا که افراد آلوده به ویروس HIV دچار ضعف ایمنی شدهاند، غیر از داروهای ضد رترویروسی نیاز به درمانهای پیشگیرانه زیر در برابر عفونتهای فرصتطلب دارند:
فلوکونازول برای درمان عفونت ازوفاژیت راجعه کاندیدایی
برای درمان عفونت راجعه هرپس سیمپلکس نوع دو از یکی از سه داروی زیر استفاده میشود:
«آسیکلوویر» (Aciclovir)
«والاسیکلوویر» (Valaciclovir)
«فامسیکلوویر» (Famciclovir)
پیشگیری از انتقال ایدز
سه روش زیر بر انتقال HIV تأثیر ویژه دارند:
تعدیل رفتاری (ترک رفتارهای پرخطر)
درمان گسترده عفونتهای منتقل شده از راه جنسی در سطح جامعه
درمان ضدرتروویروسی زنان باردار HIV مثبت
کنترل حین بارداری:
درمان مادر باردار مبتلا به HIV با داروهای ضدرترویروسی
درمان شیرخوار به مدت شش هفته، خطر انتقال عفونت از مادر به نوزاد را از 25٪ به ۲٪ کاهش میدهد.