آنزیم: تفاوت میان نسخهها
بدون خلاصۀ ویرایش |
بدون خلاصۀ ویرایش |
||
| خط ۳۹: | خط ۳۹: | ||
== سینتیک آنزیم == | == سینتیک آنزیم == | ||
در سال 1913 «لیونور میشائیلیس» (Leonor Michaelis) و «ماد منتن» (Maud Menten) یک تئوری «کمی» (quantitative) از سینتیک آنزیم را پیشنهاد دادند که به عنوان سینتیک میشائیلیس-منتن نام نهاده شد. کار آنها بعدا توسط «جورج ادوارد بریگس» (G. E. Briggs) و «جان برتون ساندرسون هالدین» (J. B. S. Haldane) توسعه یافت. کسی که معادلات سینتیکی زیادی را توسعه داد که امروزه هنوز به طور گسترده استفاده میشوند. | در سال 1913 «لیونور میشائیلیس» (Leonor Michaelis) و «ماد منتن» (Maud Menten) یک تئوری «کمی» (به انگلیسی: quantitative) از سینتیک آنزیم را پیشنهاد دادند که به عنوان سینتیک میشائیلیس-منتن نام نهاده شد. کار آنها بعدا توسط «جورج ادوارد بریگس» (G. E. Briggs) و «جان برتون ساندرسون هالدین» (J. B. S. Haldane) توسعه یافت. کسی که معادلات سینتیکی زیادی را توسعه داد که امروزه هنوز به طور گسترده استفاده میشوند. | ||
آنزیمها میتوانند تا چندین میلیون واکنش کاتالیزوری را در هر ثانیه انجام دهند. برای تعیین حداکثر سرعت یک واکنش آنزیمی، غلظت زیرلایه افزایش یافته تا تولید محصول با سرعت ثابتی بدست آید. این سرعت در واقع حداکثر سرعت (Vmax) آنزیم است. در این حالت، تمام سایتهای فعال آنزیم با زیرلایه اشباع میگردند. به این معنا که تمام آنها در تبدیل زیرلایه به محصول درگیر میشوند. | آنزیمها میتوانند تا چندین [[میلیون]] واکنش کاتالیزوری را در هر [[ثانیه]] انجام دهند. برای تعیین حداکثر [[سرعت]] یک واکنش آنزیمی، غلظت زیرلایه افزایش یافته تا تولید محصول با [[سرعت]] ثابتی بدست آید. این سرعت در واقع حداکثر سرعت (Vmax) آنزیم است. در این حالت، تمام سایتهای فعال آنزیم با زیرلایه اشباع میگردند. به این معنا که تمام آنها در تبدیل زیرلایه به محصول درگیر میشوند. | ||
در هر حال، حداکثر سرعت تنها یک پارامتر سینتیکی است که «زیست شیمیدانها» (biochemists) را علاقمند میکند. آنها همچنین میخواهند قادر به محاسبهی مقدار زیرلایهی مورد نیاز برای دستیابی به یک سرعت مشخصی از واکنش باشند. این مقدار میتواند توسط ضریب میشائیلیس-منتن (Km) بیان شود که برای رسیدن به نصف حداکثر سرعت، غلظت زیرلایه برای آنزیم نیاز میشود. هر آنزیم یک ضریب Km مشخص برای یک زیرلایه داده شده دارد. | در هر حال، حداکثر سرعت تنها یک پارامتر سینتیکی است که «زیست شیمیدانها» (به انگلیسی: biochemists) را علاقمند میکند. آنها همچنین میخواهند قادر به محاسبهی مقدار زیرلایهی مورد نیاز برای دستیابی به یک سرعت مشخصی از واکنش باشند. این مقدار میتواند توسط ضریب میشائیلیس-منتن (Km) بیان شود که برای رسیدن به نصف حداکثر سرعت، غلظت زیرلایه برای آنزیم نیاز میشود. هر آنزیم یک ضریب Km مشخص برای یک زیرلایه داده شده دارد. | ||
بازدهی یک آنزیم میتواند بر حسب kcat/Km بیان شود. مقدار kcat که «آهنگ تبدیل کاتالیزگر» (turnover number) نیز نامیده میگردد، ثابتهای سرعت برای تمام مراحل واکنش را ترکیب کرده و خارج قسمت سرعت حداکثر و غلظت آنزیم کل، kcat/Km، یک مقدار مفید برای مقایسهی کارایی نسبی آنزیمهای مختلف یا همان آنزیم که در تعامل با زیرلایههای مختلف به حساب میآید، در نظر گرفته میشود؛ زیرا «آفنیته» (affinity) و توانایی کاتالیزوری باید در نظر گرفته شوند. | بازدهی یک آنزیم میتواند بر حسب kcat/Km بیان شود. مقدار kcat که «آهنگ تبدیل کاتالیزگر» (به انگلیسی: turnover number) نیز نامیده میگردد، ثابتهای [[سرعت]] برای تمام مراحل واکنش را ترکیب کرده و خارج قسمت سرعت حداکثر و غلظت آنزیم کل، kcat/Km، یک مقدار مفید برای مقایسهی کارایی نسبی آنزیمهای مختلف یا همان آنزیم که در تعامل با زیرلایههای مختلف به حساب میآید، در نظر گرفته میشود؛ زیرا «آفنیته» (به انگلیسی: affinity) و توانایی کاتالیزوری باید در نظر گرفته شوند. | ||
آفنیته میل ترکیبی اجزای شیمیایی غیر مشابه با یکدیگر است. این اصلاح همچنین هنگامیکه دو چند اتم با ترکیب غیر یکسان با یکدیگر واکنش شیمیایی بدهند نیز بکار میرود. مقدار حداکثر تئوری برای kcat/Km که حد انتشار نامیده میشود، حدود 108 تا 109 (M-1 s-1) است. در این مرحله، هر برخورد آنزیم با زیر لایهاش به کاتالیز منجر میشود و سرعت تشکیل محصول توسط سرعت واکنش محدود نمیگردد بلکه محدودیت آن با سرعت انتشار است. آنزیمهایی که به مقدار kcat/Km میرسند، از لحاظ سینتیک یا کاتالیستی کامل هستند. نمونهای از این آنزیمها | آفنیته میل ترکیبی اجزای شیمیایی غیر مشابه با یکدیگر است. این اصلاح همچنین هنگامیکه دو یا چند [[اتم]] با ترکیب غیر یکسان با یکدیگر [[واکنش شیمیایی]] بدهند نیز بکار میرود. مقدار حداکثر تئوری برای kcat/Km که حد انتشار نامیده میشود، حدود 108 تا 109 (M-1 s-1) است. در این مرحله، هر برخورد آنزیم با زیر لایهاش به کاتالیز منجر میشود و سرعت تشکیل محصول توسط سرعت واکنش محدود نمیگردد بلکه محدودیت آن با سرعت انتشار است. آنزیمهایی که به مقدار kcat/Km میرسند، از لحاظ سینتیک یا کاتالیستی کامل هستند. نمونهای از این آنزیمها «[[تریوز فسفات ایزومرا]]<nowiki/>ز» (triose-phosphate isomerase, TIM)، «[[کربنیک آنهیدراز]]» (carbonic anhydrase)، «[[استیلکولیناستراز]]» (acetylcholinesterase)، «[[کاتالاز]]» (catalase)، «[[فوماراز]]» (fumarase)، «[[بتالاکتاماز]]» (ß-lactamase) و «[[سوپراکسید دیسموتاز]]» (superoxide dismutase) هستند. | ||
[[رده:کاتالیستهای بیولوژیکی]] | [[رده:کاتالیستهای بیولوژیکی]] | ||
[[رده:پروتئینها]] | [[رده:پروتئینها]] | ||
نسخهٔ کنونی تا ۲۷ اکتبر ۲۰۲۳، ساعت ۱۴:۰۳
آنزیم یک نوع «کاتالیست» (به انگلیسی: catalyst) بیولوژیکی است که سرعت واکنش شیمیایی را در موجود زنده تنظیم میکند. اکثر آنزیمها پروتئینها هستند؛ اگرچه برخی نوکلئیک اسیدها به نام ریبوزومها نیز قادر به انجام فعالیت کاتالیز محسوب میگردند.
آنزیمها برای حفظ حیات ضروری هستند؛ زیرا اکثر واکنشهای شیمیایی در سلولهای بیولوژیکی مانند هضم غذا، خیلی آرام اتفاق میافتند یا منجر به محصولات مختلفی بدون فعالیت آنزیمها میگردند. اکثر بیماریهای ارثی نتیجهی یک جهش ژنتیکی، تولید بیش از حد یا کمبود یک آنزیم حساس هستند. برای مثال، «عدم تحمل لاکتوز یا نارسایی لاکتاز» (به انگلیسی: lactose intolerance) که به معنای عدم توانایی هضم مقادیر قابل توجه لاکتوز، که قند اصلی در شیر است، ناشی از کمبود آنزیم لاکتاز است.
یک آنزیم برای اینکه کاربردی باشد، باید به یک شکل سه بعدی دقیق تبدیل گردد. این که چطور چنین ساختار پیچیدهای شکل میگیرد، هنوز به شکل راز باقی مانده است. یک زنجیرهی کوچک از 150 آمینواسید یک آنزیم را شکل میدهد که تعداد بسیار زیادی پیکربندی مختلف دارد؛ اگر 1012 پیکربندی مختلف در هر ثانیه آزمایش گردند، حدود 1026 سال برای یافتن و درک یک مدل زمان مورد نیاز است.
با این حال یک آنزیم «دناتوره شده یا واسرشته» (به انگلیسی: denatured) میتواند در کسری از ثانیه تغییر شکل و سپس به طور دقیق در یک واکنش شیمیایی واکنش نشان دهد. برخی دانشمندان تصور میکنند، اثرات «کوانتومی» (به انگلیسی: quantum) حتی در فواصل بزرگ (با استانداردهای اتمی) که توسط یک مولکول پروتئین ظهور میکند، منجر به ایجاد رفتارهای اینچنینی میگردد. این آنزیمها نوعی پیچیدگی مبهوتکننده و توازن یا هارمونی را در جهان اثبات میکنند.
در حالی که تمام آنزیمها نقش بیولوژیکی دارند، بعضی از آنها به صورت تجاری مورد استفاده قرار میگیرند. به عنوان مثال، بسیاری از پاککنندههای خانگی از آنزیمها برای افزایش سرعت تجزیهی لکههای پروتئین یا نشاسته روی لباسها استفاده میکنند.
مانند تمام کاتالیستها، آنزیمها هم برای کاهش انرژی فعالسازی یک واکنش یا انرژی ابتدایی لازم برای رخ دادن اکثر واکنشهای شیمیایی به کار میروند. گرما را نمیتوان به یک سیستم زنده اضافه کرد، بنابراین آنزیمها یک مسیر جایگزین را فراهم میکنند؛ آنها با یک زیرلایه (مواد موجود در واکنش شیمیایی) برای تشکیل یک «حالت گذار» (به انگلیسی: transition state)، یک «کمپلکس واسطهی ناپایدار» (به انگلیسی: unstable intermediate complex) که نیاز به انرژی کمتری برای پیشروی واکنش دارد، پیوند میدهند.
همانند یک کاتالیست، آنزیم طی واکنش تکمیل شده بدون تغییر باقی میماند؛ بنابراین میتواند به فعل و انفعال با زیرلایهها ادامه دهد. آنزیمها ممکن است طی فرایندی به خصوص سرعت واکنشها را تا چندین میلیون برابر افزایش دهند. آنزیمها میتوانند توسط مولکولهایی که فعالیت آن را افزایش میدهد، «راهانداز» (به انگلیسی: activator)، یا مولکولهایی که سبب کاهش فعالیت آنها میگردد، «مهارکننده» (به انگلیسی: inhibitor) تحت تاثیر قرار گیرند. بسیاری از داروها با مهار آنزیمها در بدن عمل میکنند و اثر خود را نشان میدهند. «آسپیرین» (به انگلیسی: aspirin) از طریق مهار آنزیمهای «COX-1» و «COX-2» کار میکند. آنزیمهایی که «پروستاگلاندین» (به انگلیسی: prostaglandin) تولید میکنند، یک پیامرسان هورمونی برای نشان دادن التهاب به شمار میروند. با مهار فعالیت این آنزیمها، «آسپیرین» (به انگلیسی: aspirin) تجربهی ما از درد و التهاب را سرکوب میکند.
ساختار
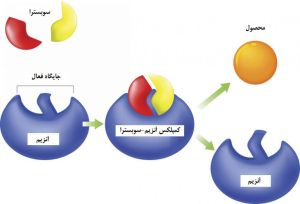
ساختار آنزیم مهم است، زیرا عملکرد خاص آنزیم در بدن را تعیین میکند. آنزیمها (و سایر پروتئینها) از زنجیرههای اسید آمینه به نام زنجیرههای «پلیپپتیدی» (به انگلیسی: polypeptide) تشکیل شدهاند. دنبالهی خطی آمینواسیدها تعیینکنندهی مشخصات تاشدگی زنجیرهها به یک ساختار سه بعدی است. یک آنزیم ممکن است فقط یک زنجیرهی پلیپپتیدی داشته باشد که معمولا یک صد آمینواسید یا تعداد بیشتری را به هم پیوند میدهد یا ممکن است شامل چندین زنجیرهی پلیپپتیدی باشد که با هم به عنوان یک واحد عمل میکنند. اکثر آنزیمها بزرگتر از زیرلایههایی هستند که روی آن عمل میکنند. فقط یک قسمت خیلی کوچک از آنزیم، تقریبا 10 آمینواسید، دارای تماس مستقیم با زیرلایهها است. این ناحیه، جایی که پیوند بین زیرلایهها و واکنش اتفاق میافتد، به عنوان سایت فعال آنزیم شناخته میشود.
عمل اختصاصی (Specificity)
آنزیمها معمولا در واکنشهایی که کاتالیز میکنند و زیرلایههایی که در این واکنشها دخیل هستند، خاص و منحصر به فرد هستند؛ یعنی فعالیت آنزیم اختصاصی است. یک آنزیم با زیرلایهاش برای تشکیل یک کمپلکس آنزیم-زیرلایه کم دوام، ترکیب میگردد. دو مدل برای توضیح چگونگی ایجاد پیوند بین آنزیم و زیرلایه وجود دارد: مدل «قفل و کلید» (به انگلیسی: lock and key) و «تناسب القایی» (به انگلیسی: induced fit).
مدل قفل و کلید
برای شناخت اختصاصی بودن آنزیمها، «امیل فیشر» (Emil Fischer) شیمیدان آلمانی، پیشنهاد داد که آنزیم یک شکل خاص دارد که زیرلایهها دقیقا متناسب آن هستند. این مدل تناسب دقیق که در سال 1890 معرفی شد، غالبا به عنوان مدل قفل و کلید شناخته میشود؛ زیرا پیوند آنزیم به یک زیرلایه شبیه به تناسب خاصی از یک قفل در یک کلید است.
مدل تناسب القایی
در سال 1958، «دانیل کشلند» (Daniel Koshland) اصلاحیهای برای مدل قفل و کلید را پیشنهاد داد. بر خلاف کلیدها، آنزیمها ساختارهای انعطافپذیر را ترجیح میدهند. سایت فعال یک آنزیم میتواند به عنوان زیرلایهای که در تعامل با آنزیم است، اصلاح شود و یک تناسب القایی بین آنزیم و زیرلایه ایجاد کند. زنجیرههای جانبی آمینواسیدها که سایتهای فعال را ایجاد میکنند، به یک شکل دقیق قالب میشوند که آنزیم را قادر میسازد فعالیت کاتالیزوری آن را انجام دهد. در برخی موارد، مولکول زیرلایه به آرامی تغییر شکل میدهد، هنگامی که به سایتهای فعال وارد میگردد.
کوفاکتورهای آنزیم
برخی آنزیمها نیاز به اجزای اضافی برای نمایش فعالیت کامل ندارند. اگرچه، دیگر آنزیمها نیازمند مولکولهای غیر پروتئینی هستند تا برای فعالیت موثر به کمپلکس پیوند داده شوند. «کوفاکتورها» (به انگلیسی: cofactors) میتوانند غیرآلی (مانند یونهای فلزی و «خوشههای آهن-سولفور» (به انگلیسی: iron-sulfur clusters)) یا ترکیبات آلی باشند که به عنوان کوآنزیمها نیز شناخته میشوند.
اکثر کوفاکتورها «پیوند کووالانسی یا پیوند اشتراکی» (به انگلیسی: covalently bound) با یک آنزیم ندارند، اما خیلی به هم وابسته هستند. با این حال، برخی از کوفاکتورها معروف به «گروههای پروتز» (به انگلیسی: prosthetic groups) به طور محکم از طریق پیوندهای کووالانسی به آنزیم پیوند میشوند. اکثر کوفاکتورها در پایان واکنشها یا احیا میگردند یا از لحاظ شیمیایی بدون تغییر میمانند. بسیاری از کوفاکتورها مشتقات ویتامینها هستند. کوفاکتورها در طول واکنش به عنوان حاملی برای انتقال الکترونها، اتمها یا گروههای عاملی از آنزیم به زیرلایه به کار میروند. نمونههای مرسوم از این مورد شامل «NAD» و «NADP» هستند که در انتقال الکترون مشارکت دارند. نمونهی دیگر «کوآنزیمآ» (به انگلیسی: coenzyme A) است که در انتقال «گروههای استیل» (به انگلیسی: acetyl groups) دخیل است.
تنظیم فعالیت آنزیم
ترکیباتی به نام مهارکنندهها میتوانند سرعت واکنش آنزیم را از طریق مهار رقابتی یا غیر رقابتی کاهش دهند. در مهار رقابتی، مهار کننده به طور مستقیم به سایتهای فعال نشان داده شده متصل شده و از اتصال زیرلایه جلوگیری میکند؛ بنابراین زیرلایه و مهار کننده برای سایتهای فعال آنزیم با هم رقابت میکنند. مهار کنندههای غیر رقابتی به سایتهای فعال متصل نمیشوند. بلکه به دیگر قسمتهای آنزیم اتصال برقرار میکنند که سبب دور شدن از سایت فعال میگردد. میزان مهار کنندگی کاملا به غلظت مهار کننده بستگی دارد و تحت تاثیر غلظت زیرلایه قرار نخواهد گرفت. به عنوان مثال، «سیانور» (به انگلیسی: cyanide) سمی با «گروههای پروتز مس» (به انگلیسی: copper prosthetic groups) از آنزیم «سیتوکروم اکسیداز سی» (به انگلیسی: cytochrome c oxidase) برای مهار «تنفس یاختهای» (به انگلیسی: cellular respiration) ترکیب میشود. این مدل از مهارکننده معمولا غیر قابل برگشت پذیر است، به این معنا که آنزیم بعد از تعامل با مهارکننده، هیچ فعالیتی نخواهد داشت.
برخی از مهارکنندههای غیر رقابتی به طور فیزیکی از طریق انسداد سایتهای فعال عمل میکنند. مهارکنندههای دیگر طوری به آنزیم متصل میگردند که ساختار سه بعدی آنزیم (ترکیب آن) را تغییر میدهند. تغییر در ساختار آنزیم، سایت فعال را مختل و آنزیم را از اتصال به زیرلایه ناتوان میسازد. در حالت دوم از مهار کنندهی غیررقابتی که مهارکنندهی «آلوستریک» (به انگلیسی: allosteric) نامیده میشود، مهارکننده به سایتهای آلوستریک وصل شده و شکل مولکول آنزیم را تغییر میدهد، به طوری که از واکنش آن با زیرلایه جلوگیری میکند.
سینتیک آنزیم
در سال 1913 «لیونور میشائیلیس» (Leonor Michaelis) و «ماد منتن» (Maud Menten) یک تئوری «کمی» (به انگلیسی: quantitative) از سینتیک آنزیم را پیشنهاد دادند که به عنوان سینتیک میشائیلیس-منتن نام نهاده شد. کار آنها بعدا توسط «جورج ادوارد بریگس» (G. E. Briggs) و «جان برتون ساندرسون هالدین» (J. B. S. Haldane) توسعه یافت. کسی که معادلات سینتیکی زیادی را توسعه داد که امروزه هنوز به طور گسترده استفاده میشوند.
آنزیمها میتوانند تا چندین میلیون واکنش کاتالیزوری را در هر ثانیه انجام دهند. برای تعیین حداکثر سرعت یک واکنش آنزیمی، غلظت زیرلایه افزایش یافته تا تولید محصول با سرعت ثابتی بدست آید. این سرعت در واقع حداکثر سرعت (Vmax) آنزیم است. در این حالت، تمام سایتهای فعال آنزیم با زیرلایه اشباع میگردند. به این معنا که تمام آنها در تبدیل زیرلایه به محصول درگیر میشوند.
در هر حال، حداکثر سرعت تنها یک پارامتر سینتیکی است که «زیست شیمیدانها» (به انگلیسی: biochemists) را علاقمند میکند. آنها همچنین میخواهند قادر به محاسبهی مقدار زیرلایهی مورد نیاز برای دستیابی به یک سرعت مشخصی از واکنش باشند. این مقدار میتواند توسط ضریب میشائیلیس-منتن (Km) بیان شود که برای رسیدن به نصف حداکثر سرعت، غلظت زیرلایه برای آنزیم نیاز میشود. هر آنزیم یک ضریب Km مشخص برای یک زیرلایه داده شده دارد.
بازدهی یک آنزیم میتواند بر حسب kcat/Km بیان شود. مقدار kcat که «آهنگ تبدیل کاتالیزگر» (به انگلیسی: turnover number) نیز نامیده میگردد، ثابتهای سرعت برای تمام مراحل واکنش را ترکیب کرده و خارج قسمت سرعت حداکثر و غلظت آنزیم کل، kcat/Km، یک مقدار مفید برای مقایسهی کارایی نسبی آنزیمهای مختلف یا همان آنزیم که در تعامل با زیرلایههای مختلف به حساب میآید، در نظر گرفته میشود؛ زیرا «آفنیته» (به انگلیسی: affinity) و توانایی کاتالیزوری باید در نظر گرفته شوند.
آفنیته میل ترکیبی اجزای شیمیایی غیر مشابه با یکدیگر است. این اصلاح همچنین هنگامیکه دو یا چند اتم با ترکیب غیر یکسان با یکدیگر واکنش شیمیایی بدهند نیز بکار میرود. مقدار حداکثر تئوری برای kcat/Km که حد انتشار نامیده میشود، حدود 108 تا 109 (M-1 s-1) است. در این مرحله، هر برخورد آنزیم با زیر لایهاش به کاتالیز منجر میشود و سرعت تشکیل محصول توسط سرعت واکنش محدود نمیگردد بلکه محدودیت آن با سرعت انتشار است. آنزیمهایی که به مقدار kcat/Km میرسند، از لحاظ سینتیک یا کاتالیستی کامل هستند. نمونهای از این آنزیمها «تریوز فسفات ایزومراز» (triose-phosphate isomerase, TIM)، «کربنیک آنهیدراز» (carbonic anhydrase)، «استیلکولیناستراز» (acetylcholinesterase)، «کاتالاز» (catalase)، «فوماراز» (fumarase)، «بتالاکتاماز» (ß-lactamase) و «سوپراکسید دیسموتاز» (superoxide dismutase) هستند.