هموگلوبین
هموگلوبین (به انگلیسی: Hemoglobin) (که به اختصار Hb نامیده میشود) یک متالوپروتئین یا پروتئین فلزی، حاوی اکسیژن در سلولهای قرمز خون است که در پستانداران و تقریباً سایر مهرهداران یافت میشود.
برخی بیمهرگان نیز در حمل و نقل اکسیژن از هموگلوبین استفاده میکنند، مانند کرمهای آنلیدی که هموگلوبین را در خون خود حل می کنند. علاوه بر این، Hb به عنوان حامل برای انتقال اکسیژن در مراحل آبی زندگی لاروی برخی حشرات نیز مشاهده شده است. تنها تعداد معدودی از مهرهداران، مانند لارو مارماهی و برخی از گونههای یخ ماهیان قطب جنوب، فاقد هموگلوبین هستند. هموگلوبین کارآمدترین حامل اکسیژن به شمار میآید که تاکنون شناخته شده است.
پروتئین هموگلوبین
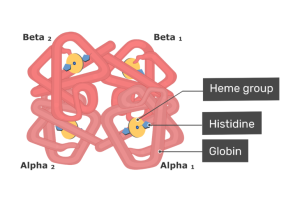
هموگلوبین به عنوان یک کمپلکس پروتئین - فلز، در شرایط مناسب با اتصالی سست و برگشتپذیر به اکسیژن متصل میشود و سپس گاز اکسیژن را تحت شرایط متفاوتی آزاد میکند. در مهرهداران، Hb اکسیژن را از ریهها یا آبششها به سایر بخشهای بدن مانند عضلات منتقل میکند، در واقع عضلات از مکانهایی هستند که هموگلوبین، اکسیژن را در آنها آزاد میکند. از نظر ساختاری، هموگلوبین یک پروتئین کروی است که در آن یک گروه آهن یا هِم (به انگلیسی: Heme) تعبیه شده است. هر گروه هِم دارای یک اتم آهن است و این گروه مسئول اتصال اکسیژن به هموگلوبین به شمار میآید. متداولترین انواع هموگلوبین شامل چهار زیر واحد است.
جهش در ژن پروتئین هموگلوبین منجر به گروهی از بیماریهای ارثی به نام «هموگلوبینوپاتی» (به انگلیسی: Hemoglobinopathies) میشود که رایجترین گونههای این گروه از اختلالات، بیماری کم خونی «سلول داسی شکل» (به انگلیسی: Sickle-Cell Disease) و «تالاسمی» (به انگلیسی: Thalassaemia) به شمار میآیند.
از آنجا که مونوکسید کربن نسبت به اکسیژن میل ترکیبی بیشتری به Hb دارد، استعمال دخانیات که موجب تولید مونو اکسید کربن در ریهها میشود، میتواند تأثیر زیادی بر حمل و نقل اکسیژن در خون داشته باشد و تا 20٪ از جایگاهای فعال اکسیژن روی هموگلوبین را مسدود میکند. این تنها یکی از تعداد بیشماری اثرات جدی و خطرناک مصرف دخانیات برای سلامتی محسوب میشود و نشانگر این است که مصرف این ترکیبات به تدریج سلولهای بدن را مسموم کرده و از بین میبرد.
هموگلوبین عاملی است که رنگ قرمز را در خون ایجاد میکند، در هنگامی که Hb با اتصال به اکسیژن، مورد اکسیداسیون قرار میگیرد، رنگ قرمز روشن به خود میگیرد و زمانی که هموگلوبین اکسیژن خود را در کنار سلولهای بدن آزاد میکند به رنگ قرمز تیره در میآید. رنگ قرمز هموگلوبین به دلیل وجود اتمهای آهن در ساختار آن است.
از Hb برای تعیین روابط تکاملی در بین موجودات زنده استفاده شده است. زنجیرههای آلفا هموگلوبین انسان و شامپانزهها توالی یکسانی از اسیدهای آمینه را دارند، در حالی که انسان در یک اسید آمینه (از 141 اسید آمینه) با گوریل و در 25 اسید آمینه با خرگوش و 71 اسید آمینه با ماهی کپور متفاوت است.
ساختار هموگلوبین
مولکول هموگلوبین از چهار زیر واحد پروتئینی کروی تشکیل شده است. هر زیر واحد از یک زنجیره پروتئین محکم با یک گروه هِم غیرپروتئینی تشکیل شده است.
هر زنجیره پروتئینی جداگانه، مجموعهای از بخشهای ساختاری مارپیچ آلفا است که به هم وصل شدهاند و یک مارپیچ میوگلوبین را ایجاد کردهاند؛ این ساختارها، میوگلوبین نامیده میشود زیرا ترتیب قرارگیری این پروتئینها مشابه موتیفهایی است که در پروتئینهای میوگلوبین مورد استفاده قرار می گیرد. این الگوی فولدینگ یا تاخوردگی حاوی یک پاکت است که محلی مناسب برای اتصال با گروه هِم به شمار میآید.
یک گروه هِم شامل یک اتم آهن است که در یک حلقه هتروسیکلیک نگهداری میشود؛ این حلقههای آلی هتروسیلیک «پورفیرین» (به انگلیسی: Porphyrin) نامیده میشود. اتم آهن محل اتصال اکسیژن در هموگلوبین محسوب میشود. اتم آهن به طور مساوی با هر چهار نیتروژن در مرکز حلقه پیوند خورده است که در یک صفحه قرار دارند. برای ایجاد موقعیتهای پنجم و ششم، دو پیوند اضافی عمود بر صفحه از هر طرف با آهن ایجاد میشود، یکی برای اتصال به پروتئین و دیگری برای اتصال اکسیژن مورد استفاده قرار میگیرد. اتم آهن میتواند به صورت یونهای Fe+2 یا Fe+3 باشد. شکلی از Hb که در آن یون Fe+3 وجود دارد، قادر به اتصال با اکسیژن نیست، به این شکل از Hb، «فری هموگلوبین» یا «متاموگلوبین» (به انگلیسی: Methaemoglobin) میگویند.
مولکول Hb انواع مختلفی دارد که ممکن است در شرایط گوناگون، هر یک از انواع آن موثر باشد. به عنوان مثال، یک نوع هموگلوبین وجود دارد که ممکن است در ارتفاعات زیاد کارایی بالاتری داشته باشد، این نوع هموگلوبین در حیواناتی مانند لاما دیده میشود. علاوه بر این برخی از انواع هموگلوبینها هم وجود دارند که در ارتفاعات پایین موثرتر عمل میکنند، از جمله این هموگلوبینها را میتوان در گردش خون گوزن دم سفید مشاهده کرد. هموگلوبین جنینی با هموگلوبین مادر نیز متفاوت است.
در انسان بالغ، متداولترین نوع Hb یک ساختار تترامر است (که شامل 4 زیر واحد پروتئینی) که به نام هموگلوبین A شناخته میشود. این نوع هموگلوبین از دو زیر واحد α و دو زیر واحد β به صورت غیر کووالانسی ساخته شده است. این ساختار تحت عنوان α2β2 شناخته میشود. زیر واحدها از نظر ساختاری مشابه و تقریباً در یک اندازه هستند. هر زیر واحد دارای وزن مولکولی حدود 16٫000 دالتون است، به این ترتیب در کل وزن مولکولی تترامر در حدود 64000 دالتون محاسبه میشود. در بین هموگلوبینها، هموگلوبین A بیشتر مورد مطالعه قرار گرفته و اطلاعات بیشتری از آن در دسترس است.
چهار زنجیره پلی پپتیدی توسط پلهای نمکی، پیوندهای هیدروژنی و تعامل آبگریز به یکدیگر متصل میشوند. بین زنجیرههای α و β دو نوع تماس وجود دارد: α1β1 و α1β2.
انواع هموگلوبینها در انسان
در ۱۲ هفته اول بعد از بارداری هموگلوبینهای زیر در جنین وجود دارند:
- در دو ماه بعد از لقاح و تشکیل جنین یک نوع هموگلوبین به نام هموگلوبین (Portland) با ساختار δ2γ2 وجود دارد.
- در هفته دهم تا دوازدهم جنینی دو نوع Hb با ترکیب ساختارهای ξ2ε2 و α2ε2 به ترتیب Grower1 و Grower2 نامیده میشود.
- در جنین بعد از ۱۲ هفتگی هموگلوبین دیگری به نام هموگلوبین F با ترکیب ساختاری α2γ2 تشکیل میشود.
- پس از این مرحله از هفته هجدهم بارداری تا هفته بیست و چهارم هموگلوبین A1 تشکیل میشود اما میزان هموگلوبین F در این دوران نسبت به هموگلوبین A بیشتر است.
بدن انسان در دوران بزرگسالی میتواند هموگلوبینهای زیر را داشته باشد:
- هموگلوبین A با ترکیب ساختاری α2β2 متداولترین نوع هموگلوبین در بدن است.
- هموگلوبین A2 با تترامر α2δ2 در بزرگسالان در حدود ۲٫۵ درصد از هموگلوبینهای خون را به خود اختصاص داده است.
- هموگلوبین F دارای ترکیب ساختاری α2γ2 است که در بزرگسالان در جمعیتهای محدود از گلبولهای قرمز که سلولهای F نامیده میشوند، وجود دارد.
نحوه اتصال هموگلوبین با مولکولهای مختلف
در فرم تترامری هموگلوبین طبیعی در بزرگسالان، اتصال اکسیژن یک «فرآیند تعاونی» (به انگلیسی: Cooperative Process) به شمار میآید. میل اتصال هموگلوبین به اکسیژن با اشباع این مولکول با اکسیژن افزایش مییابد. به همین دلیل، منحنی اتصال اکسیژن به هموگلوبین سیگموئیدی یا S شکل است، در حالی که منحنی برای اتصالات غیر تعاونی (به انگلیسی: Noncooperative) به شکل هایپربولیک طبیعی یا زنگولهای است.
این اتصالات تعاونی مثبت از طریق تغییرات اثرات فضایی کمپلکس پروتئین هموگلوبین حاصل میشود؛ هنگامی که یک زیر واحد پروتئینی در هموگلوبین اکسیژن میگیرد، یک کانفورمیشن یا تغییر آرایش ساختاری را در کل مجموعه ایجاد میکند و سبب میشود که میل ترکیبی 3 زیر واحد دیگر پروتئینی به اکسیژن افزایش یابد.
یک مولکول هموگلوبین تنها میتواند چهار مولکول اکسیژن را منتقل کند. در مهرهداران، هموگلوبینها در گلبولهای قرمز یا اریتروسیتها یافت میشوند که هر یک از آنها حاوی حدود 300 میلیون مولکول هموگلوبین هستند. هموگلوبینهای موجود در گلبولهای قرمز حدود 98٪ از اکسیژن موجود در خون انسان را منتقل میکنند.
اتصال اکسیژن به هموگلوبین تحت تأثیر حضور مولکولهایی مانند مونوکسید کربن (CO) قرار میگیرد. مونو اکسید کربن در دود حاصل از مصرف دخانیات و آلودگیهای هوا ناشی از دود خودروها و کارخانهها وارد جریان خون میشود. میل ترکیبی هموگلوبین به اکسیژن در حضور مونوکسید کربن کاهش مییابد زیرا هر دو گاز برای جایگاههای یکسان اتصال در هموگلوبین با یکدیگر رقابت میکنند، این در حالی است که میل ترکیبی هموگلوبین به مونو اکسید کربن نسبت به اکسیژن بیشتر است.
اندازهگیری هموگلوبین
هموگلوبین معمولا به عنوان بخشی از آزمایش شمارش کامل سلولهای خونی در آزمایشهای خون روتین مورد بررسی قرار میگیرد. روشهای متعددی برای اندازهگیری هموگلوبین وجود دارد. اغلب این روشها در حال حاضر با دستگاههای اتوماتیک در تستهای خونی مورد استفاده قرار میگیرد.
درون این دستگاه گلبولهای قرمز خون شکسته میشوند تا هموگلوبین از آنها خارج شود و در محلول قرار بگیرد. هموگلوبینهای آزاد در معرض یک محلول شیمیایی قرار میگیرند که دارای سیانید است و با اتصالات محکمی به مولکولهای هموگلوبین متصل میشود تا سیانومتهموگلوبین ساخته شود. با تابش نور به این محلول و اندازهگیری میزان نور جذب شده (به خصوص در طول موج ۵۴۰ نانومتر) میزان هموگلوبین تعیین میشود.
دلیل اندازهگیری هموگلوبین خون
Hb به عنوان یکی از فاکتورهای مهم خونی در اکثر آزمایشها مورد بررسی قرار میگیرد. از جمله شرایطی که نیاز به شمارش این پروتئین در خون دارند، شامل موارد زیر هستند:
- بررسی سابقه خانوادگی مشکلات خونی مانند بیماری کم خونی داسی شکل
- وجود عفونت در بدن
- کمبود آهن در رژیم غذایی
- از دست دادن خون در حین عمل جراحی یا بر اثر جراحت شدید
- در زمان بارداری
- وجود بیماری در فرد که بر هموگلوبین تاثیر میگذارد.
برای انجام این آزمایش نیاز به شرایط ناشتایی نیست.
میزان هموگلوبین بالا
میزان بالای Hb نشان دهنده برخی از بیماریهای نادر مانند «پلی سیتمی» (به انگلیسی: Polycythemia) است. در این بیماری بدن گلبولهای قرمز را بیش از حد طبیعی تولید میکند که سبب میشود غلظت خون افزایش یابد. غلظت خون موجب ایجاد رسوب و انسداد عروق، سکته و حملات قلبی میشود. این بیماری ممکن است در مواردی موجب مرگ بیمار شود.
میزان هموگلوبین میتواند دلایل دیگری از قبیل کمبود آب، بیماریهای مزمن قلبی یا ریوی، مصرف بیرویه اریتروپویتین، سیگار کشیدن یا زندگی در مناطقی با ارتفاع بالا داشته باشد.
از جمله علائم وجود میزان بالایی از این پروتئین در خون میتوان به موارد زیر اشاره کرد:
- خارش پوستی
- سردرد
- سرگیجه
- خونریزی مکرر
- تعریق بیش از حد معمول
- مفاصل دردناک
- کاهش وزن غیرطبیعی
- وجود لکههای زرد در چشم و پوست (زردی)
- احساس خستگی مفرط
- راشهای قرمز و کبود پوستی
میزان هموگلوبین پایین
میزان پایین Hb نشان دهنده کم خونی در فرد است. انواع متفاوتی از کم خونی وجود دارد که شامل موارد زیر هستند:
- کم خونی فقر آهن: از متداولترین انواع کم خونی به شمار میآید. این آنمی زمانی که فرد به میزان کافی آهن در بدن خود برای تولید Hb ندارد، اتفاق میافتد. این نوع آنمی معمولا با کاهش میزان خون به وجود میآيد، اما گاهی این بیماری به دلیل جذب کم آهن رخ میدهد.
- کم خونی بارداری: نوعی کم خونی فقر آهن است که به دلیل بارداری و زایمان، که در این حالت بدن به مقادیر بالای آهن احتیاج دارد، اتفاق میافتد.
- کم خونی فقر ویتامین: زمانی ایجاد میشود که در رژیم غذایی مواد مغذی مانند ویتامین B12 یا فولیک اسید بسیار کم باشد. این بیماری موجب تغییر در شکل و کارایی گلبولهای قرمز میشود.
- آنمی آپلاستیک: نوعی اختلال است که در سلولهای بنیادی سازنده خون در مغز استخوان ایجاد میشود، زمانی که این سلولها توسط سیستم ایمنی بدن مورد حمله قرار میگیرند، گلبولهای قرمز کاهش پیدا میکنند.
- آنمی همولیتیک: نوعی کم خونی است که در شرایط خاص و یا به صورت ارثی در فرد بروز مییابد. این بیماری زمانی رخ میدهد که گلبولهای قرمز خون در جریان خون یا در طحال شکسته شوند.
- کم خونی داسی شکل: یک بیماری ژنتیکی است که در آن پروتئین هموگلوبین ساختار غیرطبیعی دارد. در این بیماری گلبولهای قرمز شکلی شبیه داس و ساختمان شکننده دارند، به همین دلیل در عبور از رگهای خونی باریک، اغلب این گلبولهای قرمز غیرطبیعی دچار مشکل میشوند و در این رگها انسداد ایجاد میکنند.
کم خونی گاهی در شرایطی دیگر نیز به وجود میآید؛ به عنوان مثال، در بیماریهای کلیوی و در طول دوره شیمی درمانی برای درمان سرطان ممکن است توانایی گلبولهای قرمز تحت تاثیر قرار گرفته و تغییر کند. از جمله علائم انواع کمی خونی و کمبود Hb میتوان به موارد زیر اشاره کرد: